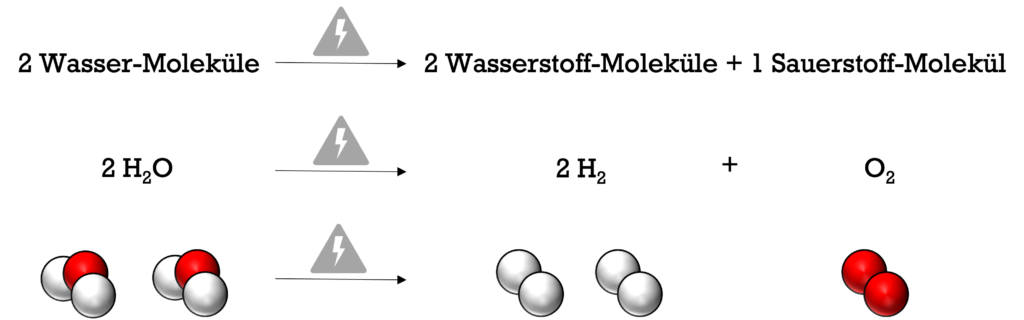
Bei der Wasserelektrolyse wird elektrische Energie in chemische Energie umgewandelt. Wasser-Moleküle werden dabei elektrochemisch zu Wasserstoff-Molekülen und Sauerstoff-Molekülen umgesetzt. Die gesamte Reaktionsgleichung sieht dabei so aus:
Die Reaktion läuft in einer sogenannten elektrochemischen Zelle ab. Doch wie ist diese aufgebaut? Schauen wir uns dafür die untenstehende schematische Darstellung einer elektrochemischen Zelle an. Diese sieht auf den ersten Blick ziemlich kompliziert aus. Also gehen wir das Prinzip Schritt für Schritt durch.
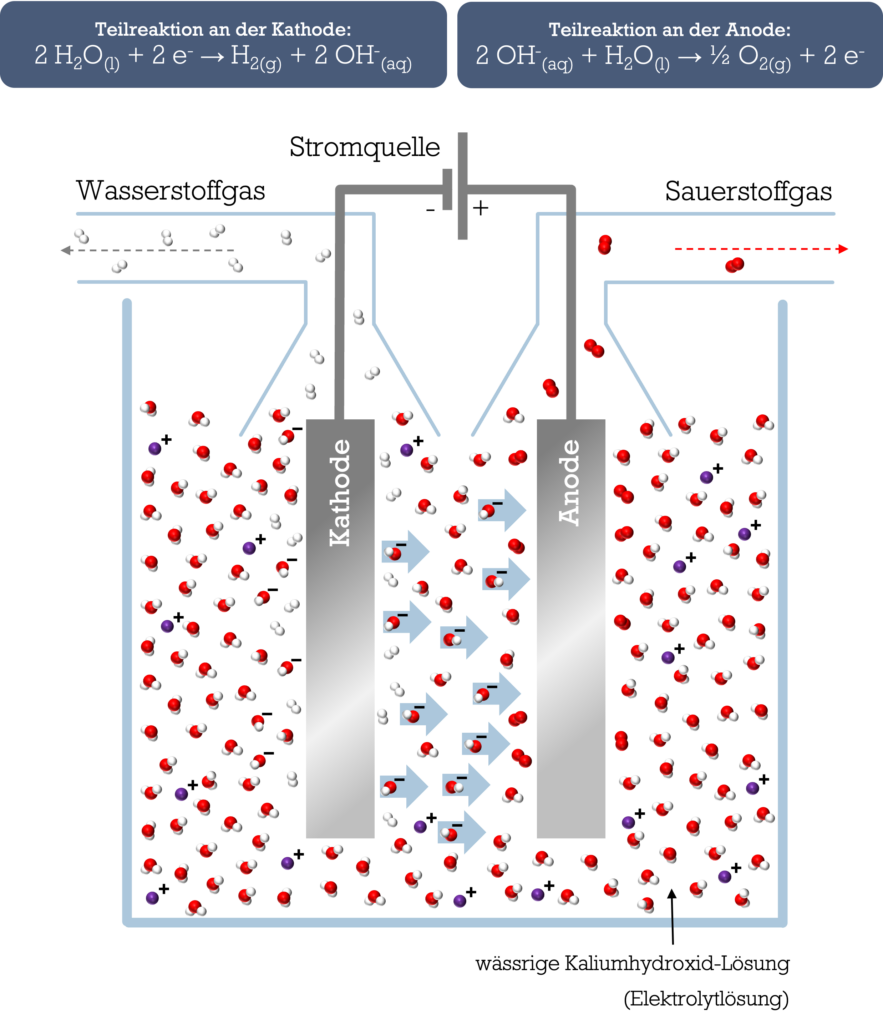

Wie du in der Abbildung erkennen kannst, beinhaltet die elektrochemische Zelle zwei Elektroden: eine Anode und eine Kathode. Beide bestehen aus elektrisch leitfähigem Material und sind in eine wässrige Elektrolytlösung eingetaucht. In der Elektrolytlösung sind Ionen die frei-beweglichen Ladungsträger, die für die elektrische Leitfähigkeit verantwortlich sind. Im Fall der alkalischen Elektrolyse-Zelle hat die Lösung einen leicht basischen pH-Wert (pH > 7 = basisch).
Um die Wasser-Moleküle (H2O) zu zerlegen und daraus Wasserstoffgas und Sauersoffgas zu gewinnen, wird elektrischer Strom an die elektrochemische Zelle angelegt. Stammt die elektrische Energie aus erneuerbaren Quellen, spricht man von “grünem” Wasserstoff.
Die zugeführte elektrische Energie wird nun innerhalb der elektrochemischen Zelle in chemische Energie umgewandelt. Das bedeutet konkret: es finden an den Oberflächen der Kathode und der Anode zwei unterschiedliche Reaktionen (Reduktion und Oxidation) statt. Beide Reaktionen laufen gleichzeitig ab, daher spricht man von einer Red-Oxreaktion. An der Kathode findet die Reduktion statt, bei der Elektronen aufgenommen werden. An der Anode findet die Oxidation statt bei der Elekronen abgegeben werden. Beide Reaktionen laufen zeitgleich ab:
- An der Kathode findet die Reduktion statt. An der Oberfläche der Kathode werden Wasser-Moleküle durch Zufuhr von Elektronen zu negativ geladenen Hydroxid-Ionen und Wasserstoff-Molekülen umgesetzt. Hier wird also der “grüne” Wasserstoff gewonnen. Die entstandenen negativ geladenen Hydroxid-Ionen wandern zur positiv geladenen Anode.
2 H2O(l) + 2 e– → H2(g) + 2 OH–(aq)
- An der Anode läuft die Oxidation ab. Dabei reagieren die Hydroxid-Ionen unter Elektronenabgabe zu Wasser-Molekülen und Sauerstoff-Molekülen. Die Wasser-Moleküle können dann erneut umgesetzt werden.
2 OH–(aq) + H2O(l) → ½ O2(g) + 2 e–
Wie du anhand der Reaktionsgleichung oben sehen kannst, kommt es durch die Elektrolyse selbst nicht zu Kohlenstoffdioxidgas-Emissionen. Nichtsdestotrotz kann es je nach Wahl der Energiequelle oder auch durch Transportwege, Erschließung, Rohstoffe etc. zur Bildung von “indirekten” Kohlenstoffdioxidgas-Emissionen kommen.
Gewinnt man den für die Elektrolyse nötigen Strom aus fossilen Rohstoffen, entstehen für ein Kilogramm Wasserstoffgas bis zu 23kg Kohlenstoffdioxidgas. Nutzt man Wind- oder Solarenergie zur Stromgewinnung, fallen im Zuge der Wasserelektrolyse bis zu 95% weniger Kohlenstoffdioxidgas-Emissionen an.
Gestaltung der Station: Felix Sperrer, Alexandra Tepla, MEd BSc und Mag.a Martina Zodl
Wenn du mehr über Wasserstoff wissen willst, findest du hier Tipps zum Weiterlesen:
