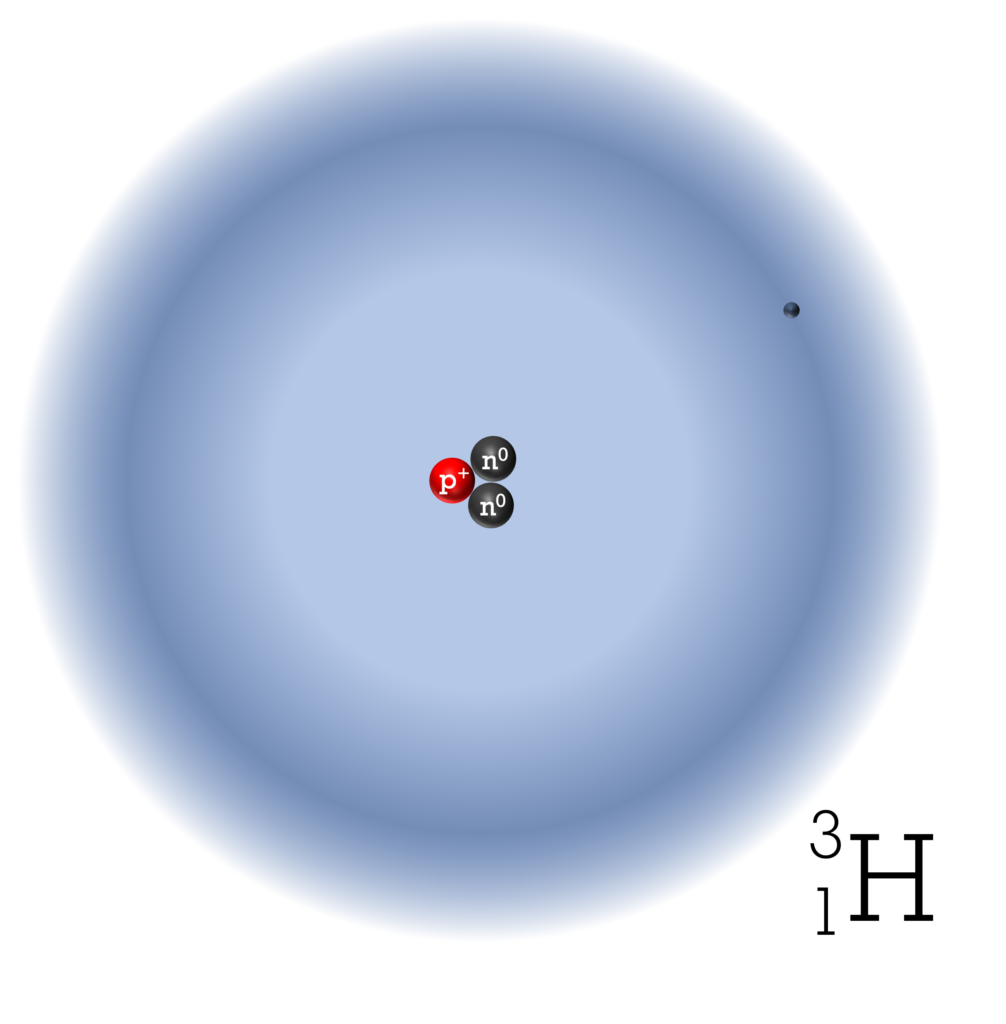
Das Element Wasserstoff hat im Periodensystem die Ordnungszahl 1, sein Elementsymbol ist H. Wasserstoff gibt es in drei unterschiedlichen Varianten: 1H (Protium), 2H (Deuterium D) und 3H (Tritium T). Solche Varianten nennt man “Isotope”. Die Isotope von Wasserstoff unterscheiden sich in ihren Eigenschaften so stark, wie bei keinem anderen Element. Am häufigsten kommt Protium vor mit einem Anteil von über 99,9%. Protium besitzt ein Proton im Atomkern. Deuterium und Tritium haben zusätzlich ein bzw. zwei Neutronen im Atomkern. Allen Isotopen ist gemeinsam, dass jedes Atom ein Elektron in der Elektronenhülle hat. In der Abbildung sind die Isotope des Wasserstoffs mit ihren Protonen und Neutronen sowie ein Wassertoffmolekül modellhaft dargestellt. Die blauen „Wolken“ symbolisieren den Raum, in dem sich die Elektronen befinden.


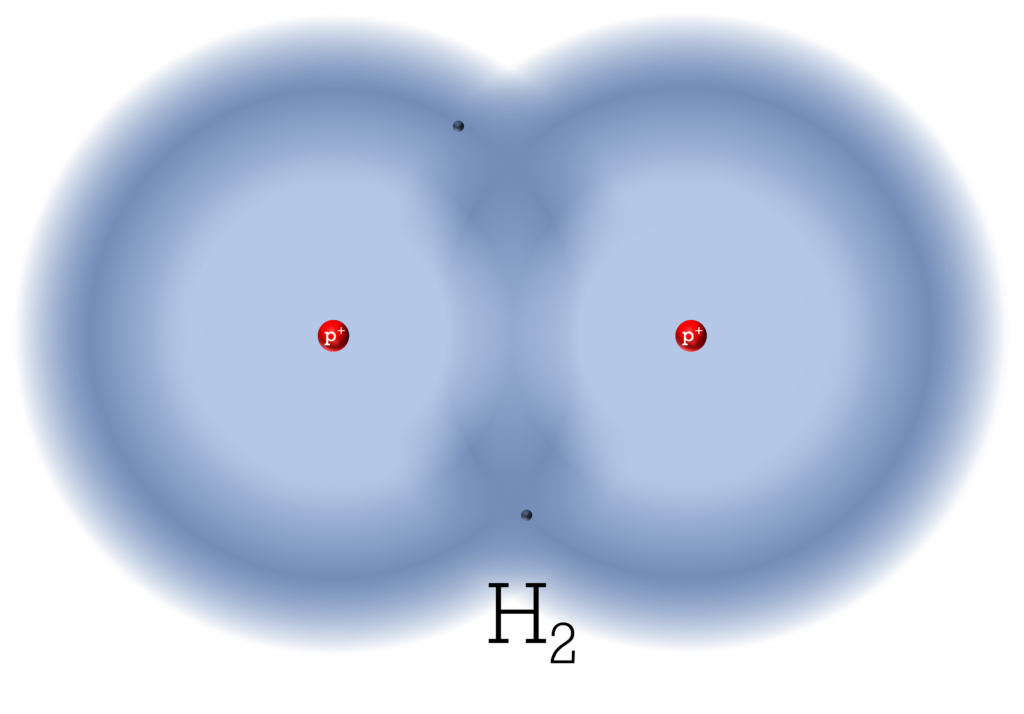
Unter Standardbedingungen liegt Wasserstoff als Wasserstoffgas vor. Wasserstoffgas besteht aus zweiatomigen Wasserstoff-Molekülen (H2). Daher wird Wasserstoffgas auch als molekularer Wasserstoff bezeichnet.
Physikalische Eigenschaften
Molekularer Wasserstoff hat seinen Siedepunkt bei -253 °C und seinen Schmelzpunkt bei -259 °C. Kühlt man molekularen Wasserstoff auf unter -253 °C ab, wird er flüssig. Bei Temperaturen unterhalb von -259 °C wird molekularer Wasserstoff fest. Bei Raumtemperatur ist molekularer Wasserstoff gasförmig – man spricht dann von Wasserstoffgas.
Wasserstoffgas ist geruch- und farblos und das Gas mit der geringsten Dichte. Mit 0,0899 g/L ist Wasserstoffgas etwa 14-mal leichter als Luft. Daher wurde es auch als Auftriebsmittel genutzt: 1783 eröffnete der französische Physiker Jacques Charles mit der Verwendung von Wasserstoffgas eine neue Ära in der Luftfahrt, indem er den ersten mit Wasserstroffgas gefüllten Ballon steigen ließ!

Der Einsatz von Wasserstoffgas als Trägergas in der Luftfahrt birgt jedoch auch zahlreiche Gefahren. Spätestens bei der Hindenburg-Katastrophe, welche am 6. Mai 1937 stattfand, wurde dies deutlich. Bei diesem Unfall starben 35 Menschen als sich das Wasserstoffgas im Zeppelin LZ 129 entzündete und das nach dem deutschen Reichspräsidenten Paul von Hindenburg benannte Luftschiff in Flammen aufging. Das Unglück geschah während der Landung nach einem Flug von Frankfurt am Main (Deutschland) nach Lakehurst (New Jersey, USA). Bis heute ist die Ursache für die Katastrope nicht vollständig geklärt. Am wahrscheinlichsten haben elektrische Entladungen zur Entzündung des Wasserstoffgases geführt.

Wasserstoff-Moleküle haben eine sehr geringe Masse und bewegen sich deshalb äußerst schnell im Gas, was zu einem großen Diffusionsvermögen führt. Das bedeutet, dass sich das Wasserstoffgas leicht in einem Raum ausbreitet und sich so mit anderen Gasen, wie Luft, vermischt. Das birgt vor allem Herausforderungen in der Speicherung und Lagerung von Wasserstoffgas. Wenn du mehr darüber wissen willst, welche Möglichkeiten zur Speicherung und Lagerung von Wasserstoffgas bestehen, geht es hier lang:
Chemische Eigenschaften
Die Bindung zwischen den beiden Wasserstoff-Atomen eines Wasserstoff-Moleküls ist sehr stabil: 431 Kilojoule pro Mol müssen aufgewendet werden, um die Bindung zu trennen. Das bedeutet, dass molekularer Wasserstoff reaktionsträge ist. Nur unter sehr hohen Temperaturen finden Reaktionen statt.
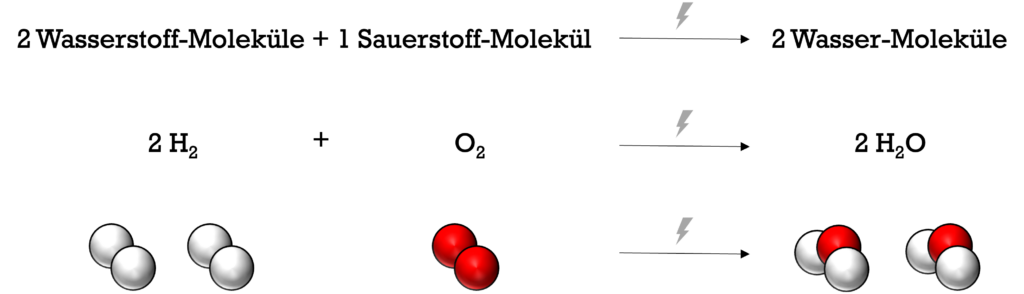
Im Jahr 1766 experimentierte der englische Physiker und Chemiker Henry Cavendish mit sauren Lösungen und Metallen und stellte dabei zunächst unwissentlich Wasserstoffgas her. Er nannte das Gas „brennbare Luft“ (“inflammable air”) aufgrund seiner Fähigkeit zu brennen. Reines Wasserstoffgas brennt an der Luft mit schwach bläulicher Flamme. Bei dieser chemischen Reaktion reagieren Wasserstoff-Moleküle mit Sauerstoff-Molekülen und es bilden sich Wasser-Moleküle.
Derselbe Vorgang findet auch bei der “Knallgasreaktion” statt. Diese Reaktion wurde bereits 1671 vom Wissenschaftler Robert Boyle entdeckt. Dabei reagierten Wasserstoffgas und Sauerstoffgas in einem Mischungsverhältnis von 2:1 bei Zündung mit einem lauten Knall zu Wasserdampf, der sich an der Wand des Reaktionsgefäßes in Form von flüssigem Wasser niederschlägt. Die Knallgasreaktion eignet sich, um Wasserstoffgas nachzuweisen. Im folgenden Video siehst du, wie die Knallgasreaktion in der Praxis abläuft:
Wie kam der Wasserstoff zu seinem Namen? Der französische Wissenschaftler Antoine Laurent de Lavoisier zeigte 1783, dass aus Cavendishs „brennbarer Luft“ durch Verbrennung Wasser hergestellt werden kann. Er gab dem Gas den Namen „hydro-gène„, was soviel wie Wasserbildner heißt. Im international gültigen Periodensystem der Elemente hat Wasserstoff den griechisch-lateinischen Namen Hydrogenium, der mit „H“ abgekürzt wird.
Gestaltung der Station: Felix Sperrer, Alexandra Tepla, MEd BSc und Mag.a Martina Zodl
Wenn du mehr über Wasserstoff wissen willst, findest du hier Tipps zum Weiterlesen:
