Wasserstoffgas kann auch als Energiequelle im Mobilitätssektor eingesetzt werden. Man bedient sich dabei der Rückverstromung in Brennstoffzellen. Im Gegensatz zur Wasserelektrolyse, wo elektrische Energie in chemische Energie umgewandelt wird, wird in einer Brennstoffzelle chemische Energie in elektrische Energie umgewandelt. Man spricht hierbei auch vom “Gas-to-Power”-Konzept. In einer Brennstoffzelle wird in einer kontrollierten Knallgasreaktion aus Wasserstoffgas und Sauerstoffgas Wasser synthetisiert. Die dabei freiwerdende elektrische Energie kann z.B. zum Betreiben von Elektromotoren verwendet werden. Durch diese Energieumwandlung wird eine Alternative zu herkömmlichen benzin- oder dieselbetriebenen Motoren geschaffen.
Eine bedeutender Typ der Brennstoffzelle ist die alkalische Wasserstoff-Sauerstoff-Brennstoffzelle.
Schauen wir uns das Prinzip dahinter einmal genauer an:
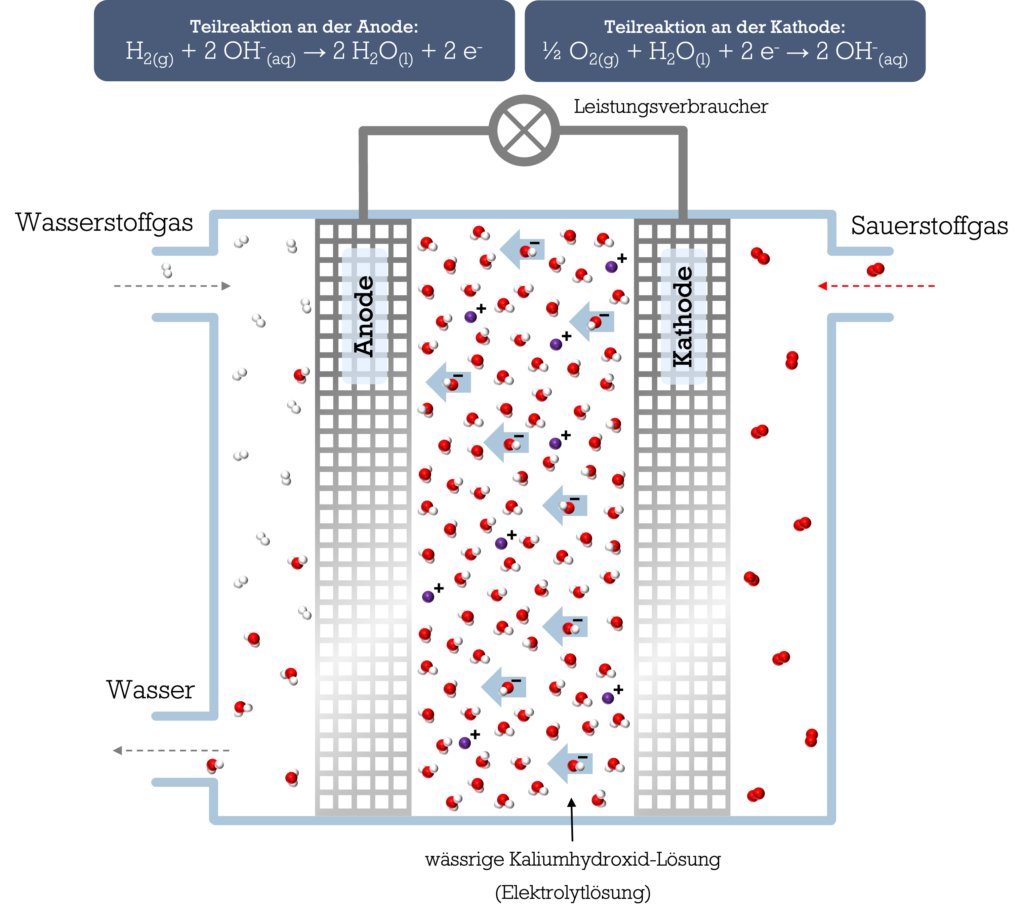
Der Name der Zelle kommt daher, weil Wasserstoffgas und Sauerstoffgas als „Brennstoffe“ fortlaufend zugeführt werden. Wie in der elektrochemischen Zelle finden auch hier Red-Ox-Reaktionen statt. In der Brennstoffzelle dient das Wasserstoffgas als Reduktionsmittel und das Sauerstoffgas als Oxidationsmittel.
Eine Brennstoffzelle besteht aus zwei Elektroden: einer Anode und einer Kathode, zwischen denen sich eine wässrige Elektrolytlösung befindet. Bei der alkalischen Brennstoffzelle wird eine wässrige Kaliumhydroxid-Lösung als Elektrolyt eingesetzt. In dieser Elektrolytlösung bewegen sich Hydroxid-Ionen (OH–-Ionen).
Wasserstoffgas wird zur Anode geleitet, wo die Wasserstoff-Moleküle unter Freisetzung von je zwei Elektronen mit den Hydroxid-Ionen des Elektrolyten zu Wasser-Molekülen reagieren. Wasserstoff wird also an der Anode oxidiert (Elektronen werden abgegeben).
H2(g) + 2 OH–(aq) → 2 H2O(l) + 2 e–
An der Kathode reagieren Sauerstoff-Moleküle mit Wasser-Molekülen unter Aufnahme von Elektronen zu Hydroxid-Ionen. Die entstandenen Hydroxid-Ionen wandern zur Anode, wodurch die Reaktionen erneut ablaufen. Sauerstoff wird also an der Kathode reduziert (Elektronen werden aufgenommen).
½ O2(g) + H2O(l) + 2 e– → 2 OH–(aq)

Gestaltung der Station: Felix Sperrer, Alexandra Tepla, MEd BSc und Mag.a Martina Zodl
Wenn du mehr über Wasserstoff wissen willst, findest du hier Tipps zum Weiterlesen:
